资讯 | 《耳聋基因突变检测试剂盒》行业标准3月1日起实施!-4188云顶集团
2023-02-22 09:02:52
13
2021年9月6日,国家药监局组织制定了 《耳聋基因突变检测试剂盒》行业标准, 该标准将于2023年3月1日起实施!
本标准由国家药品监督管理总局提出。本标准由全国医用临床检验实验室和体外诊断系统标准化技术委员会(sac/tc 136)归口。
本标准起草单位:中国食品药品检定研究院、河南省医疗器械检验所、深圳华大智造科技有限公司、广州市达瑞生物技术股份有限公司、山东英盛生物技术有限公司、广州凯普医药科技有限公司、中生北控生物科技股份有限公司、广州市金圻睿生物科技有限责任公司、北京博晖创新生物技术股份有限公司。本标准主要起草人:于婷、张娟丽、邹姑、吴英松、冯振、郑氽、黄茜、陈嘉吕、柳春霞、黄杰、曲守方、贾峥。
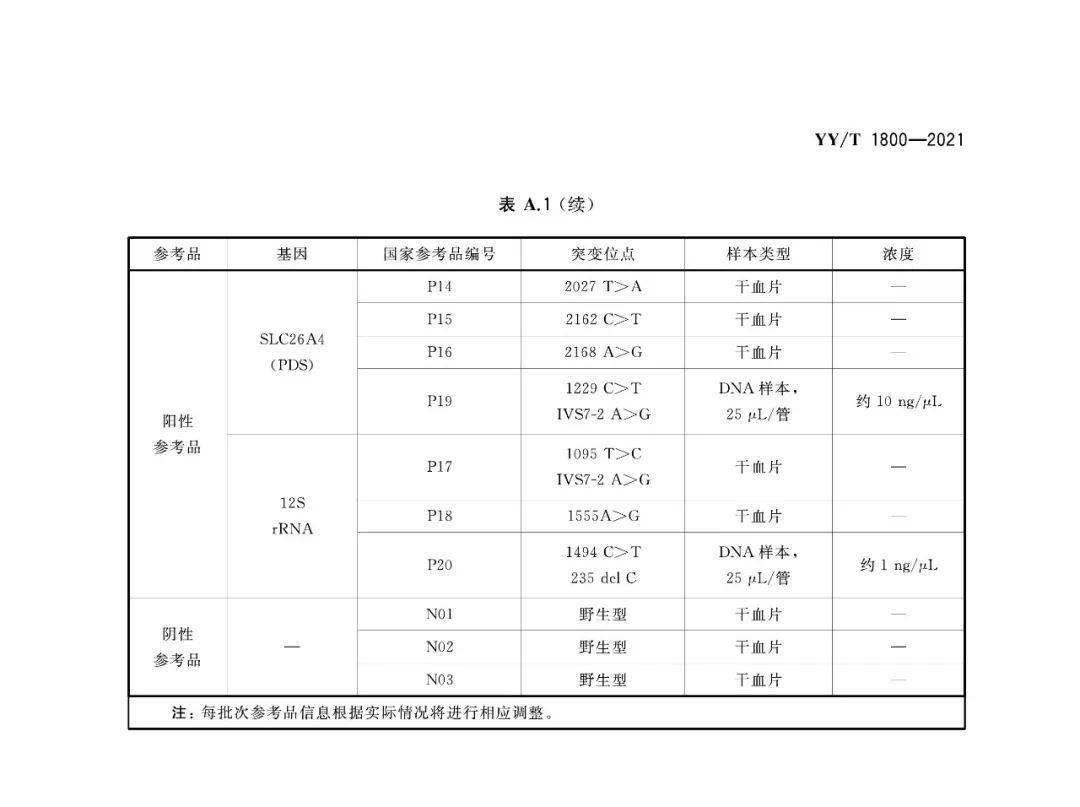
本标准适用于芯片法、质谱法、pcr法(如荧光pcr法、pcr-荧光探针法、荧光pcr熔解曲线法等)等耳聋基因突变检测试剂盒,不适用于测序法为原理的耳聋基因突变检测试剂盒。
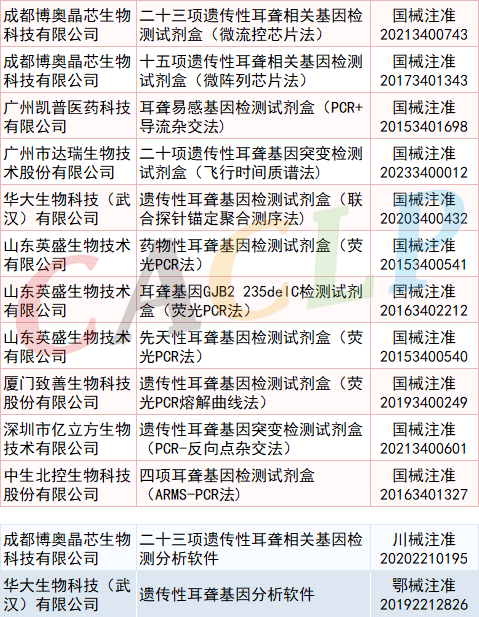
目前已有11款相关检测试剂、2款软件产品获批上市。
(按企业名称拼音首字母排序)
行业标准
电子文本仅供参考,请以正式标准出版物为准







(来源:)