前沿 | 世界首个crispr基因编辑疗法上市申请获受理,来自诺奖团队-4188云顶集团
2023年1月26日,crispr therapeutics和vertex公司向欧洲药品管理局(ema)递交的crispr基因编辑疗法exagamglogene autotemcel(exa-cel)得上市申请获得受理,这意味着,exa-cel有望于今年在欧洲获得批准,成为首个上市的crispr-cas9治疗药物。
exa-cel是由crispr therapeutics和vertex公司合作开发的一款用于治疗镰状细胞病和β-地中海贫血的基于crispr-cas9基因编辑的自体细胞疗法,能够帮助患者有效摆脱输血和血管阻塞危机。
然而,在获得欧洲批准后,该疗法在欧洲面临的挑战或许才刚刚开始,此前,蓝鸟生物(bluebird bio)于2019年开发的治疗β-地中海贫血的慢病毒自体细胞疗法获得欧洲药品管理局(ema)的有条件许可上市,但两年后因为销售额太低而退出欧洲市场,这也表明了欧洲当前的医保体系对于这种昂贵的前沿疗法可能是一个不利环境。
因此,crispr therapeutics和vertex公司在向欧洲药品管理局(ema)递交上市申请的同时,也正在向美国市场推进,据悉,他们将在今年一季度末完成向美国食品药品监督管理局(fda)的滚动递交。
exa-cel疗法的临床试验数据此前于2020年12月发表在了《新英格兰医学杂志》(nejm),论文题为:crispr-cas9 gene editing for sickle cell disease and β-thalassemia。

治疗原理及临床试验结果
bcl11a是一种转录因子,可抑制红系细胞中的γ-珠蛋白和胎儿血红蛋白表达。因此,靶向抑制bcl11a在理论上可以重新激活γ-珠蛋白表达,从而治疗地中海贫血症和镰状细胞病。
研究团队从健康供体获得了cd34 造血干细胞和祖细胞,然后通过电穿孔导入特异性靶向bcl11a增强子的crispr-cas9基因编辑系统。检测结果表明该位点的等位基因约有80%被编辑,且没有脱靶编辑的迹象。
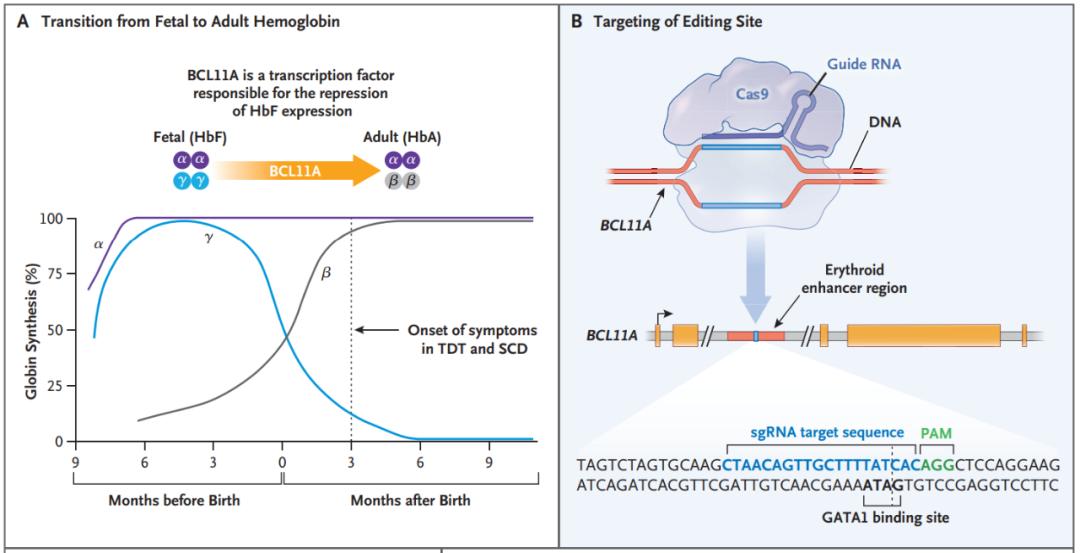
然后研究团队对1名β-地中海贫血症患者和1名镰状细胞病患者回输了经过crispr-cas9编辑bcl11a增强子的自体cd34 细胞。
治疗后18个月,两名患者的骨髓和血液中等位基因编辑水平仍保持较高,骨髓中保持超过76%的编辑效率,血液中的编辑效率也保持在60%。且患者不再依赖输血,循环血液中表达胎儿血红蛋白hbf的细胞占比达到99%。
crispr therapeutics的创始人是2020年凭借crispr基因编辑获得诺贝尔化学奖的埃玛纽埃尔·卡彭蒂耶(emmanulle charpentier)。(来源:澎湃新闻·澎湃号·湃客)